Lekcja 3 – Mieszaniny gazów i bilans substancji

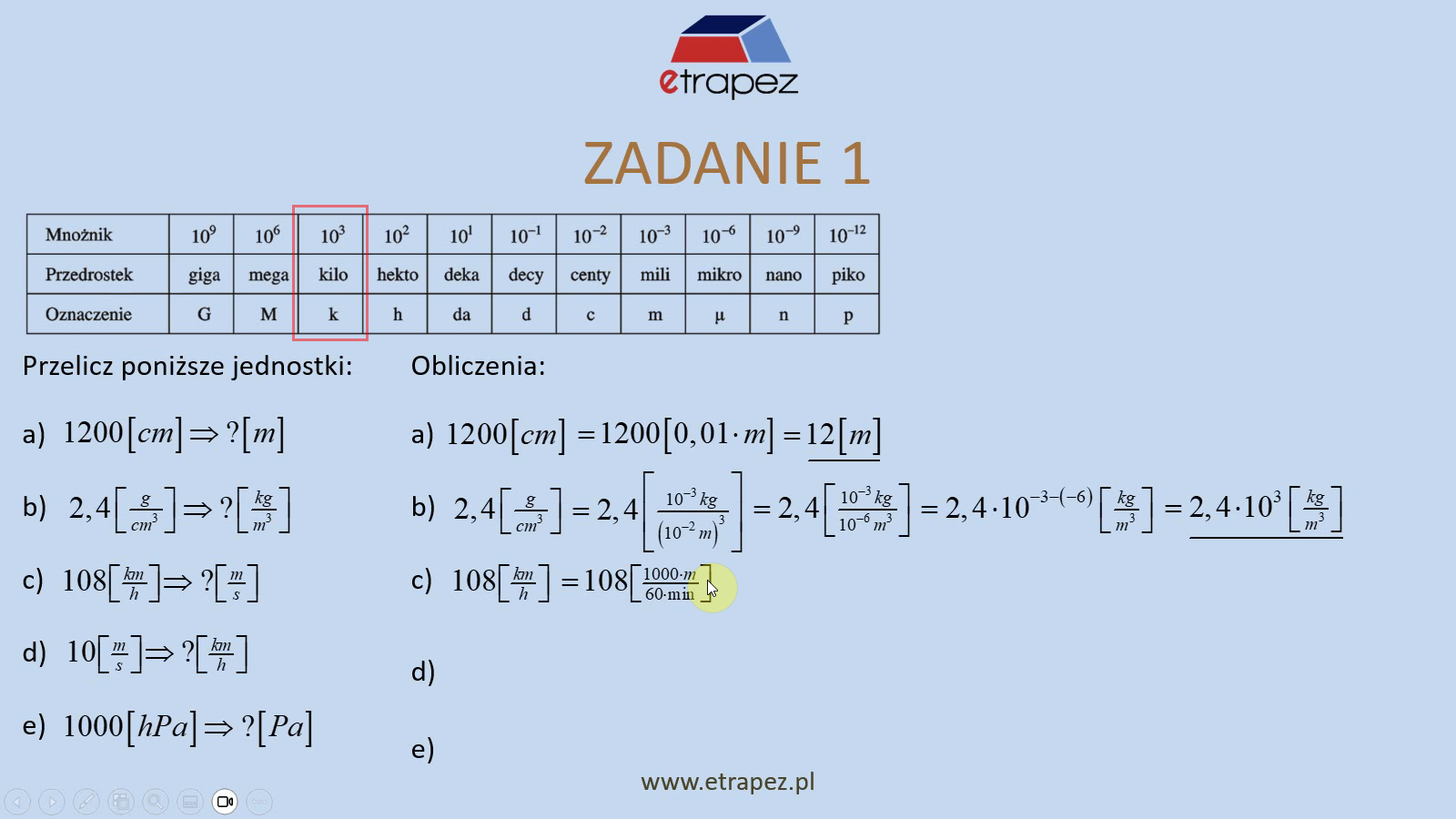
<p>Lekcja trzecia to lekcja w której uczysz się sprawnie przechodzić między opisami składu, liczyć parametry mieszaniny i rozwiązywać typowe zadania rachunkowe z bilansu substancji.</p> <p>Lekcja ta ma lekko ponad 1 godzinę. Jest o mieszaninach gazów idealnych: jak definiować i przeliczać udziały molowe/objętościowe, masowe oraz jak wyznaczać z nich masę molową M i stałą gazową mieszaniny. Ćwiczenia pokazują użycie Prawa Daltona do ciśnień cząstkowych, a także liczenie liczby cząstek i bilansowanie składu po zmieszaniu porcji gazów.</p> <hr /><hr /> <h3>Spis treści:</h3> <ul> <li>udział składników: stężenie masowe, molowe i objętościowe, masa molowa i stała gazowa, gęstość i objętość właściwa, prawo Daltona i ciśnienie cząstkowe [03:20]</li> <li>zadanie 1: podane stężenie masowe i objętościowe tlenu (w powietrzu), udział masowy i objętościowy azotu, ciśnienie cząstkowe obu składników oraz stała gazowa i masa molowa powietrza (jako gaz doskonały), ilość cząstek w masie <em>m </em>[15:30]</li> <li>zadanie 2: stała gazowa mieszaniny trzech gazów [32:55]</li> <li>zadanie 3: ciśnienie mieszaniny gazów (ciśnienie cząstkowe): udziały objętościowe i masowe składników oraz masa molowa i stała gazowa roztworu [41:23]</li> <li>zadanie 4: mieszanina dwóch gazów, podane stężenia molowe, dodano inną mieszaninę gazów, ilość moli i stężenie molowe poszczególnych gazów [50:04]</li> <li>zadanie 5: podana stała gazowa mieszaniny dwóch gazów, stężenia masowe i molowe [58:03]</li> </ul>